Основные параметры химических источников тока
Химические источники тока: основные характеристики

Принцип работы
Окислительно-восстановительная реакция, протекающая между веществами, обладающими свойствами окислителя и восстановителя, сопровождаются выделением электронов, движение которых образует электрический ток. Однако, чтобы использовать его энергию, необходимо создать условия для прохождения электронов через внешнюю цепь, в противном случае она при простом смешивании окислителя и восстановителя выделяется во внешнюю среду теплом.
Поэтому все химические источники тока имеют два электрода:
анод, на котором происходит окисление;
катод, осуществляющий восстановление вещества.
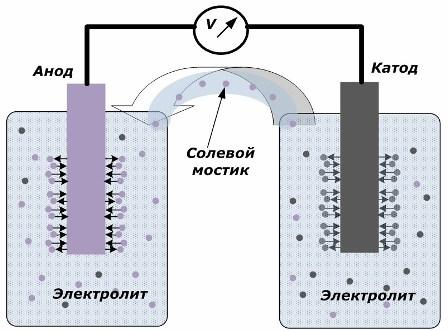
Электроды на расстоянии помещены в сосуд с электролитом — веществом, проводящим электрический ток за счет процессов диссоциации среды на ионы.
Принцип преобразования химической энергии в электрическую
На рисунке показано, что электроды размещены в отдельных сосудах, соединенных солевым мостиком, через который создается движение ионов по внутренней цепи. Когда внешняя и внутренняя цепь разомкнуты, то на электродах протекают два процесса: переход ионов из металла электрода в электролит и переход ионов из электролита в кристаллическую решетку электродов.
Скорости протекания этих процессов одинаковы и на каждом электроде накапливаются потенциалы напряжения противоположных знаков. Если их соединить через солевой мостик и приложить нагрузку, то возникнет электрическая цепь. По внутреннему контуру электрический ток создается движением ионов между электродами через электролит и солевой мостик. По внешней цепи возникает движение электронов по направлению от анода на катод.
Практически все окислительно-восстановительные реакции сопровождаются выработкой электроэнергии. Но ее величина зависит от многих факторов, включающих объемы и массы используемых химических веществ, примененных материалов для изготовления электродов, типа электролита, концентрации ионов, конструкции.
Наибольшее применение в современных химических источниках тока нашли:
для материала анода (восстановителя) — цинк (Zn), свинец (Pb), кадмий (Cd) и некоторые другие металлы;
для материала катода (окислителя) — оксид свинца PbO2, оксид марганца MnO2, гидроксооксид никеля NiOOH и другие;
электролиты на основе растворов кислот, щелочей или соли.
Способы классификации
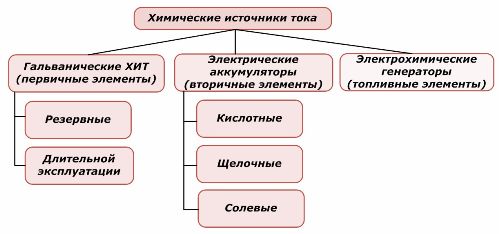
Одна часть химических источников тока может повторно использоваться, а другая нет. Этот принцип взят за основу их классификации.
Классификация химических элементов
Электродвижущая сила гальванических элементов, в зависимости от конструкции, достигает 1,2÷1,5 вольта. Для получения больших значений их объединяют в батареи, соединяя последовательно. При параллельном подключении батарей увеличивается ток и мощность.
Принято считать, что первичные химические источники тока не поддерживают повторную зарядку, хотя более точно это положение можно сформулировать по-другому: ее проведение экономически не целесообразно.
Резервные первичные химические источники тока хранятся в состоянии, когда электролит изолирован от электродов. Это исключает протекание окислительно-восстановительной реакции и обеспечивает готовность к вводу в работу. Они не используются повторно. Срок хранения резервных химических источников тока ограничен в 10÷15 лет.
Аккумуляторы успешно перезаряжаются приложением внешней электрической энергии. Благодаря этой возможности их называют вторичными источниками тока. Они способны выдерживать сотни и тысячи циклов заряда-разряда. ЭДС аккумулятора может быть в пределах 1,0÷1,5 вольта. Их тоже объединяют в батареи.
Электрохимические генераторы работают по принципу гальванических элементов, но у них для проведения электрохимической реакции вещества поступают извне, а все выделяющиеся продукты удаляются из электролита. Это позволяет организовать непрерывный процесс.
Основные рабочие характеристики химических источников тока
1. Величина напряжения на разомкнутых клеммах
В зависимости от конструкции единичный источник может создавать только определенную разность потенциалов. Для использования в электрических устройствах их объединяют в батареи.
2. Удельная емкость
За определенное время (в часах) один химический источник тока может выработать ограниченное количество тока (в амперах), которые относят к единице веса либо объема.
3. Удельная мощность
Характеризует способность единицы веса или объема химического источника тока вырабатывать мощность, образованную произведением напряжения на силу тока.
4. Продолжительность эксплуатации
Еще этот параметр называют сроком годности.
5. Значение токов саморазряда
Эти побочные процессы электрохимических реакций приводят к расходу активной массы элементов, вызывают коррозию, снижают удельную емкость.
6. Цена на изделие
Зависит от конструкции, применяемых материалов и ряда других факторов.
Лучшими химическими источниками тока считаются те, у которых высокие значения первых четырех параметров, а саморазряд и стоимость низкие.
Принципы заряда аккумуляторов
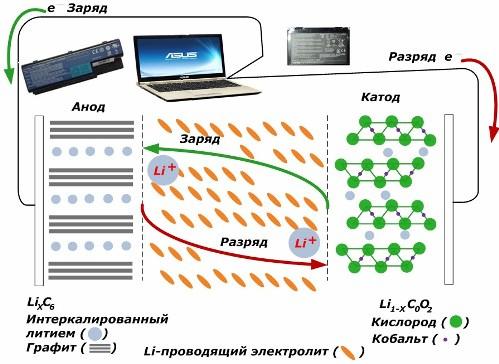
Среди вторичных химических источников тока большую популярность набирают литий ионные модели, которые стали массово применяться для питания электронных устройств. У них материалом положительного электрода используется LiMO2 (M Co, Ni, Mn), а отрицательного — графит.
При заряде ионы лития от приложенной внешней энергии выделяются из металла катода, проходят через электролит и проникают в пространство между слоями графита, накапливаясь там.
Когда энергия зарядного устройства отсутствует, а к электродам подключена нагрузка, то ионы лития в электролите двигаются в противоположную сторону.
Если заряд и разряд не проводятся, то энергия в аккумуляторе не расходуется, а сохраняется. Но ее количество ограничивается свойствами применяемых материалов. К примеру, у литий-ионных аккумуляторов значение удельной электроемкости составляет 130÷150 мАч/г. Оно лимитировано свойствами материала анода. Для графита емкость выше примерно в два раза.
Ученые сейчас ищут способы повышения емкости аккумулятора, изучают возможности использования химической реакции, проходящей между литием и кислородом воздуха. Для этого разрабатываются конструкции с воздушным, не расходуемым катодом, используемые в отдельных аккумуляторах. Этот метод может до 10 раз увеличить плотность энергии.
Эксплуатация химических источников тока требует знания основ электротехники, электрохимии, материаловедения и физики твердых тел.
Химические источники тока – где применяются, и каков принцип действия
Химические источники тока (сокращенно ХИТ) – это источники электродвижущей силы (ЭДС), в которых в электрическую энергию превращается энергия протекающих внутри химических реакций. Используют их сегодня повсеместно – это и современные электромобили и портативная радиоэлектроника, и медицинское оборудование, и портативные компьютеры.
Все это делает источники тока электрохимические очень важным изобретением, которым пользуются вот уже 2-ю сотню лет. Именно про ХИТ мы подробно и поговорим в сегодняшней статье.
Классификация химических источников тока
Все ХИТ принято подразделять на три основные категории:
Интересно знать! Напомним, что именно поток электронов и приводит к возникновению электрического тока.
Характеристики гальванических источников тока
Характеристика химических источников тока включает в себя следующие параметры:
Совет! Чем выше температура, тем быстрее сокращается срок хранения.
Интересно знать! Для никель-кадмиевых аккумуляторов, функционирующих исправно, не допускается потеря более 10% от максимального заряда за 1 сутки. Никель-металлгидридные имеют меньший показатель, а у литий-ионных этот эффект практически отсутствует, растягиваясь на месяцы. Герметичные кислотные аккумуляторы потеряют за год всего 40% своего заряда, однако, если температура воздуха будет выше 20 градусов, процесс потечет куда быстрее, и наоборот, приближаясь к нулю – будет замедляться.
Более подробное строение элементов
Мы уже дали определение химических источников тока и назвали их основные типы. Теперь давайте рассмотрим немного глубже, как они устроены, и какие химические реакции внутри протекают.
Про литий-ионные аккумуляторы мы поговорим в отдельной главе, так как эти устройства на сегодня в быту самые часто встречающиеся.
Литий-ионные аккумуляторные батареи
Теперь, как и обещали, давайте подробно обсудим, что такое литий-ионные аккумуляторы, как они устроены и как ими правильно пользоваться. Тема очень интересная, и поможет не только увеличить объем теоретических знаний, но и практических, которые, к примеру, помогут продлить срок службы вашего телефонного или любого другого аккумулятора.
Строение
Принцип работы
Разберем сначала разряд.
Чтобы восполнить запас энергии, процесс нужно обратить вспять. К аккумулятору подключается зарядное устройство, из-за чего электроны устремляются обратно к аноду, пока тот не соберет прежнее количество электронов. Далее цикл может повторяться большое количество раз.
Емкость литий-ионной батареи – это ни что иное, как количество ионов лития, которые могут «прилипнуть» к электродам. Попадают они в кратеры (микроскопические поры на аноде и катоде).
Характеристики аккумуляторов
Изготавливаемые сегодня литий-ионные аккумуляторы бывают двух видов: таблеточные и цилиндрические.
Все они могут иметь следующие рабочие параметры и характеристики:
Для таких аккумуляторов характерны следующие плюсы:
Интересно знать! Эффект памяти – это изменение полезной емкости аккумулятора, из-за нарушения режима зарядки. То есть, если постоянно заряжать не до конца севший аккумулятор, он «запомнит» нижний порог и будет «считать» его нулевым.
Советы по эксплуатации аккумуляторов
А теперь самые простые советы, которые помогут прослужить вашим аккумуляторам максимально долго.
Совет! Прилагаемая к аккумуляторным батареям инструкция обычно содержит рекомендации по режиму зарядки.
На этом закончим наш обзор. Мы разобрали электрохимические источники тока и получили простейшее представление об их работе. Если вы хотите изучить тему глубже, то уже не обойтись без учебных пособий и видео, которые можно легко отыскать в сети.
Химические источники тока на все случаи жизни: литиевые батарейки
Химические источники тока (ХИТ) прочно вошли в нашу повседневную жизнь. Практически каждый из нас имел дело с гальваническими элементами, но не каждому эта встреча могла оставить приятные воспоминания. Случалось, что батарейки почему-то работали меньше, чем ожидалось, у них быстро снижалось напряжение, или нагрузка просто отказывалась нормально функционировать с некоторыми типами элементов. В этом случае, как правило, мы считали виноватым производителя элементов и редко допускали, что могла быть и доля нашей собственной вины. Может быть, в данном случае элемент повел себя так, как и должен был? Ведь различные нагрузки нуждаются и в различных источниках тока. Например, фотоаппарат со вспышкой требует кратковременного, но достаточно большого тока, а цифровому аудиоплееру, наоборот, требуется длительный ток небольшой величины.
Если в бытовом применении потребитель редко обращает внимание на отличия используемых химических источников тока — для него они просто батарейки и аккумуляторы, то для применения в промышленном оборудовании необходимо обладать полной информацией о существующих источниках и их различиях между собой. Это требуется для того, чтобы избежать возможных ошибок, связанных с неправильным применением источников тока в том или ином приложении.
Химический источник тока — это устройство, непосредственно преобразующее энергию химической реакции, протекающей между анодом и катодом, в электрическую энергию. Все химические источники по способности к повторному использованию подразделятся на две большие группы: первичные источники тока и вторичные источники тока. Первичные источники тока (элементы) обеспечивают только разряд и не могут заряжаться — они используются однократно. Вторичные источники тока (аккумуляторы) могут заряжаться и использоваться многократно в циклическом режиме «заряд-разряд».
В мире производится несколько основных типов химических источников тока (солевые, щелочные, литиевые и др.) и достаточно большое количество их разновидностей, различающихся типом электрохимической системы, электрической емкостью, допустимыми токами разряда и саморазряда, а также — другими параметрами. Некоторые параметры основных типов первичных источников тока приведены в таблице 1 (ориентировочная электрическая емкость указана при непрерывном разряде тока 10 мА).
Таблица 1. Параметры первичных ХИТ
Таблица 4. Литий-тионилхлоридные элементы
| Наименование | Тип корпуса | Рабочее напряжение, В | Номинальная емкость, мАч | Ток разряда, мА | Ток разряда макс., мА | Размеры, мм | Температурный диапазон, °С | Производитель | ||
|---|---|---|---|---|---|---|---|---|---|---|
| пост. | имп. | диаметр | высота | |||||||
| Повышенной емкости цилиндрические | ||||||||||
| ER10450 | AAA | 3,6 | 700 | 1 | 5 | 30 | 10,2 | 46,2 | -55…85 | EEMB |
| ER14250 | 1/2АА | 3,6 | 1200 | 0,5 | 40 | 80 | 14,5 | 25,2 | -55…85 | EEMB |
| ER14250 | 3,6 | 1200 | 0,5 | 15 | 50 | 14,5 | 25,4 | -55°…85 | EVE | |
| ER14505 | АA | 3,6 | 2400 | 2 | 100 | 200 | 14,5 | 50,5 | -55…85 | EEMB |
| ER14505 | 3,6 | 2700 | 1 | 40 | 150 | 14,5 | 50,5 | -55…85 | EVE | |
| ER26500 | С | 3,6 | 9000 | 2 | 230 | 400 | 26,0 | 50,0 | -55…85 | EEMB |
| ER26500 | 3,6 | 8500 | 4 | 150 | 300 | 26,0 | 50,0 | -55…85 | EVE | |
| ER341245 | DD | 3,6 | 36000 | 2 | 450 | 1000 | 34,0 | 124,5 | -55…85 | EEMB |
| ER341245 | 3,6 | 35000 | 10 | 420 | 500 | 33,1 | 124,5 | -55…85 | EVE | |
| С повышенным током разряда цилиндрические | ||||||||||
| ER14505M | AA | 3,6 | 1800 | 10 | 500 | 1000 | 14,5 | 50,5 | -55…85 | EEMB |
| ER14505M | 3,6 | 2000 | 4 | 400 | 1000 | 14,7 | 50,7 | -40…85 | EVE | |
| ER26500M | C | 3,6 | 6500 | 10 | 1000 | 2000 | 26,2 | 50 | -55…85 | EEMB |
| ER26500M | 3,6 | 6000 | 10 | 1000 | 2000 | 26,2 | 50 | -40…85 | EVE | |
| ER34615M | D | 3,6 | 14000 | 10 | 2000 | 3000 | 34 | 60,5 | -55…85 | EEMB |
| ER34615M | 3,6 | 13000 | 15 | 2000 | 4000 | 33,1 | 61,5 | -40…85 | EVE | |
| С расширенным температурным диапазоном цилиндрические | ||||||||||
| ER14505S | AA | 3,6 | 1600 | 100 | 100 | — | 14,5 | 50,5 | -20…125 | EEMB |
| ER14505S | 3,6 | 1600 | нд | нд | — | 14,7 | 50,5 | -40…150 | EVE | |
| ER26500S | C | 3,6 | 4800 | 35 | 100 | — | 26,2 | 50 | -20…150 | EEMB |
| ER26500S | 3,6 | 6000 | нд | нд | — | 26,9 | 50 | -40…150 | EVE | |
| ER34615S | D | 3,6 | 10500 | 35 | 200 | — | 34 | 60,5 | -20…150 | EEMB |
| ER34615S | 3.6 | 13000 | нд | нд | — | 33,9 | 61,5 | -40…150 | EVE | |
Следующим важным преимуществом группы литиевых элементов является сверхмалый ток саморазряда (потеря 1…2,5% емкости в год). Благодаря столь малой потере емкости рассматриваемые типы элементов могут храниться в обычных условиях больше 10 лет, при этом емкость снизится всего на 10%. Самым малым током саморазряда, как видно из таблицы 1, обладают литий-тионилхлоридные элементы.
Долгий срок хранения и низкий ток саморазряда литий-тионилхлоридных элементов — это, конечно, неоспоримый плюс. Такое свойство обеспечивается тонкой изолирующей пленкой хлорида лития, которая возникает на поверхности литиевого электрода. Пленка образуется из-за химической реакции, возникающей еще во время сборки элемента. Образовавшаяся пленка прекращает химическую реакцию и резко уменьшает ток саморазряда, в результате этого имеем элемент с длительным сроком хранения практически без ухудшения параметров. Но есть и отрицательная сторона этого процесса. Если к элементу подключить нагрузку, потребляющую достаточно большой ток, то на батарее (нагрузке) в начальный момент времени окажется пониженное напряжение около 2,3…2,7 В, хотя на холостом ходу напряжение будет нормальным 3,3…3,6 В. Это происходит из-за того, что образовавшаяся изолирующая пленка не может разрушиться мгновенно и препятствует протеканию тока (обладает достаточно высоким сопротивлением). В процессе хранения элемента толщина изолирующей пленки увеличивается. Этот процесс называется пассивацией литиевого элемента. Пассивации подвержены литиевые элементы всех производителей без исключения.
Степень пассивации элемента зависит от времени и условий его хранения, а также — от режима эксплуатации. Чем больше период хранения и выше температура, тем толще пленка. Значительные негативные проявления эффекта пассивации начинаются после 5…6 месяцев хранения в нормальных условиях, либо после длительного использования элемента в микротоковом режиме (единицы микроампер и менее).
В реальной жизни часто встречаются устройства, работающие большую часть времени в ждущем режиме (например, какие-либо датчики). Приборы длительное время потребляют ток в несколько микроампер или десятков микроампер, а по свершению некоторого события должны включиться в режим среднего или большого энергопотребления. В этом случае, если в приборе установлена батарея после длительного хранения, или режим микропотребления длился очень долго, то переход в режим повышенного энергопотребления может и не произойти. Элемент выдаст пониженное напряжение.
Пониженное напряжение в меньшей степени влияет на устройства с малым потреблением тока. В момент подключения такой нагрузки напряжение на элементе снизится незначительно, и устройство будет работать, однако процесс пассивации продолжится, и в какой-то момент времени устройство может отключиться, или его работа станет неустойчивой. Для таких устройств не следует использовать энергоемкие литиевые источники тока.
При подключении нагрузки, потребляющей несколько миллиампер (средняя нагрузка), произойдет понижение напряжения и затем, через некоторое время, оно восстановится до нормального значения. Это объясняется тем, что при потреблении указанного тока имеющаяся пленка с течением времени разрушится, а постоянно протекающий или протекающий с достаточно короткими промежутками времени ток будет препятствовать ее образованию.
Пониженное напряжение на элементе, потребляющем большой ток (десятки миллиампер), в момент подключения нагрузки может нарушить его работу, или же он просто не включится. Замена элемента на новый (только что купленный и не бывший в эксплуатации) ситуацию не исправит, а проверка нагрузки покажет, что с ее схемой все в порядке. Получается следующая ситуация: установили новый элемент питания — и прибор перестал работать!
Подобный случай встречался в практике автора данной статьи. При работе на одном из предприятий пришлось подготавливать некоторое изделие к серийному выпуску. Изделие состояло из нескольких отдельных устройств. Одно из устройств имело особенность — его рабочий режим был импульсным, с достаточно большим током потребления (пульт дистанционного управления). В качестве источника питания в изделие разработчиком были заложены литиевые элементы. В то время подобные элементы были не особенно распространены, а их «особенности» не были широко известны, и отдел закупок приобрел партию похожих по основным параметрам элементов (по напряжению и емкости). Эти элементы были поставлены в устройство и оказалось, что у всех устройств, уже проверенных и настроенных, резко сократилась дальность связи. Посчитали, что элементы долго хранились и потеряли часть емкости (они на самом деле достаточно долго хранились). Была закуплена еще одна партия элементов (более «свежих») — кардинально ситуация не улучшилась. Когда стали разбираться — выяснилось, что данные элементы обладают эффектом пассивации. В дальнейшем проблему смогли устранить некоторой доработкой схемы (подключили несколько электролитических конденсаторов параллельно элементу питания). Первые включения устройства стали происходить за счет части энергии, накопленной в конденсаторах, и одновременно с этим импульсы тока депассивировали элемент.
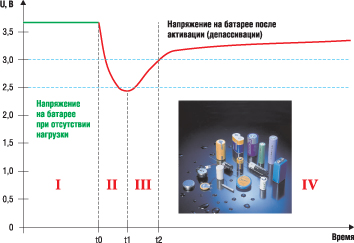
Литий-тионилхлоридные элементы перед использованием необходимо депассивировать, т. е. разрушить изолирующую пленку хлорида лития импульсом тока. На рисунке 3 показан график, поясняющий депассивацию литий-тионилхлоридных первичных источников тока.
Рис. 3. Напряжение на элементе в процессе депассивации
На графике имеется четыре области:
Для активации ни в коем случае нельзя делать короткое замыкание выводов элемента питания. Подобный метод приведет к выходу элемента из строя. Существуют рекомендованные производителем максимально допустимые значения тока и времени депассивации. В таблице 5 указаны режимы депассивации для некоторых элементов компании EEMB.
Таблица 5. Параметры для депассивации литий-тионилхлоридных элементов EEMB
| Наименование | Ток активации макс., мА | Срок хранения/время активации, с | Напряжение после депассивации, В | Производитель | ||
|---|---|---|---|---|---|---|
| 3 месяца | 6 месяцев | 12 месяцев | ||||
| ER14250 | 80 | 15 | 30 | 60 | >3,0 | EEMB |
| ER14505 | 200 | |||||
| ER26500 | 260 | |||||
| ER34615 | 460 | |||||
| ER14505M | 1000 | |||||
| ER26500M | 2000 | |||||
| ER34615M | 3000 | |||||
Максимальное значение тока депассивации для литий-тионилхлоридных элементов можно определить по правилу:
макс. импульсный ток > макс. ток депассивации