Параметры морской воды в аквариуме таблица
Справочник аквариумиста
Морская и Пресноводная аквариумистика. Наш Питомник и Аквамагазин всё на одном сайте!
Параметры и контроль качества воды в морском аквариуме
Соленость – это то количество соли, которое останется при выпаривании 1литра морской воды. Соленость может измеряться в граммах на килограмм, но всемирно принятая единица измерения солености – промилле (‰), то есть одна тысячная доля.
Например, солёность воды составляет 35 ‰, означает, что из общей массы воды 35 тысячных занимают соли. Так, если взять 1 кг кг воды солёностью в 35 ‰, то в такой воде будет 35 г солей.
Для рифового аквариума нормальный уровень солености около 35 ‰. Не стоит забывать о том, что за счет испарения уровень воды в аквариуме постепенно снижается и соленость при этом будет возрастать. Проще всего отметить первоначальный уровень воды в аквариуме и доливать полученную путем осмоса и профильтрованную воду. При использовании САМПа уровень воды нужно поддерживать в сливной емкости. При внесении пресной воды необходимо осуществлять контроль за показателями солености, не допуская ее снижения за допустимые пределы. Кроме того, часть соли теряется вместе с пеной при работе пеноотделителей. Особенно важно сохранять постоянный уровень солености в аквариумах с кораллами. Кораллы плохо переносят даже незначительные, в 2-3%, колебания солености.
2. Щелочность и карбонатная жесткость воды.
Щелочность – это способность содержащихся в воде анионов слабых кислот (карбонатов, гидрокарбонатов, силикатов, сульфитов, фосфатов и др.) связывать эквивалентное количество сильных кислот. Различают бикарбонатную, карбонатную и гидратную щелочность. Но, как правило, щелочность определяется анионами угольной кислоты (карбонатная щелочность), так как концентрация остальных анионов незначительна. Следовательно, щелочность тесно связана с показателями жесткости воды.
Таким образом щелочность в морском аквариуме имеет существенное значение, так как определяет способность воды не менять показатель жесткости рН при добавлении кислоты. Поддержание рН в стабильном состоянии – важный шаг на пути к благополучному морскому аквариуму со здоровыми обитателями.
Единицы измерения щелочности — миллиэквиваленты на литр (мэкв/л). Оптимальный для морского аквариума диапазон показателей щелочности 2,5-3,5 мэкв/л, что соответствует щелочности морской воды в природной среде. Однако, существуют мнения, что для рифового аквариума значение щелочности может повышаться до 5 мэкв/л.
Единицы измерения карбонатной жесткости — немецкие градусы жесткости dKH.
Желательный уровень карбонатной жесткости воды в морском аквариуме должен составлять от 12 до 18 dКН.
3. Кальций.
В случае если аквариум заселен беспозвоночными содержание кальция в воде является важным параметром, так как используется ими для наращивания скелета.
Уровень кальция должен быть от 400 до 500 ppm, показатель 360ppm – нижняя критическая граница. Кальций из воды быстро расходуется, поэтому поддержание его количества на оптимальном уровне – одна из насущных задач при содержании морского аквариума с кораллами.
4. Магний
Вода для морского аквариума должна содержать магний, который выполняет роль своеобразного стабилизатора. При осаждении карбоната кальция (например в результате повышения жесткости), магний покрывает поверхность образующихся кристаллов, тем самым замедляя процесс осаждения. Без магния поддерживать показатели кальция и щелочности на постоянном уровне было бы проблематично из-за выпадения карбоната кальция в осадок. Таким образом магний влияет на баланс щелочности и кальция. Кроме этого, магний используется кораллами в построении скелетов. Рекомендуемая концентрация магния в морском аквариуме 1250-1400.
Если вода в морском аквариуме содержит переизбыток фосфатов, то это приводит к замедлению кальцификации у кораллов, а также может вызвать рост водорослей. Желательная концентрация фосфатов в морском аквариуме составляет не более 0,03 ppm.
Необходимые тесты для соленой воды:
1. Аммиак (NH3)
2. Соленость (SG)
3. Температура (C)
4. Щёлочность (КН)
Если в аквариуме есть кораллы, добавляем:
5. Кальций (Ca)
6. магний (Mg)
7. фосфат (PO4)
8. нитрат (NO3)
9. нитрит (NO2)
10. pH (для соленой воды)
Параметры воды в аквариуме — pH, нитраты, фосфор
1. Важность кислорода и углекислого газа в аквариуме и изменение их количества.
Вода является хорошим растворителем для многих соединений, в том числе газов в воздухе: кислорода и углекислого газа.
1.1. Кислород O 2 и его значение
Содержание кислорода в воде зависит от многих факторов: от глубины резервуара, температуры воды, наличия растений и животных. Воды, которые находятся в движении, обычно лучше насыщены кислородом, чем стоящие. Зависимость температуры от степени оксигенации обратно пропорциональна — с повышением температуры насыщение воды кислородом уменьшается. Вода в аквариуме насыщается кислородом прежде всего из воздуха. Если он остается неподвижным, только его верхние слои насыщаются кислородом. Дополнительным производителем кислорода являются здоровые растения, выращенные нами. Получателями кислорода являются рыбы и другие аквариумные животные, микроорганизмы, живущие в воде (в основном в субстрате, в фильтре) и ночью (в темноте), а также в растениях. Отсюда необходимость дополнительного проветривания ночью (приведение воды в движение). В хорошо оксигенированном аквариуме происходит кислородное разложение органических загрязнителей и окисление органических соединений (белков, углеводов или жиров) до простых соединений, легко усваиваемых рыбой и растениями. Процессы анаэробного разложения (недостаток кислорода в аквариуме) приводят к образованию ядовитых веществ, вредных для обитателей аквариума (например, сероводород, органические кислоты, полициклические ароматические углеводороды), которые являются причиной, среди прочего, неприятный запах.
Чтобы увеличить количество кислорода в аквариуме, необходимо установить дополнительный фильтр или аэратор, заменить его на новый или ввести больше растений в аквариум.
1.2. Углекислый газ СО 2 и его значение
В течение дня углекислый газ выделяется рыбой и другими водными животными, возникает в процессах разложения органических соединений, а ночью также выделяется растениями. Избыток этого газа в воде способствует аквариум с небольшим количеством растений, недостаточной вентиляцией и чрезмерным удобрением субстрата. Чрезмерное количество растений по отношению к рыбам в аквариуме также не рекомендуется — днем это приводит к дефициту углекислого газа и кислорода ночью. Это также является причиной биологической декальцинации воды (растения извлекают углекислый газ из бикарбонатов кальция и карбонатов кальция). Только аквариум поддерживает биологический баланс (количество рыб по отношению к растениям, оптимальная температура, pH, жесткость воды, количество света, систематическая очистка и замена воды, соответствующие фильтры и аэраторы, сыпучий субстрат) способен эффективно функционировать на благо нашей рыбы и растений. Следует также упомянуть, что избыток углекислого газа может вызвать снижение pH. Если мы преувеличиваем количество этого газа при подаче в аквариум (выше 50 мг / литр), тогда рН может упасть до уровня, при котором рыба может начать умирать. Я приведу здесь несколько примеров зависимости значения рН от количества диоксида углерода, растворенного в воде:
| Карбонатная жесткость kH [° dKH] | Количество углекислого газа в воде | ||
|---|---|---|---|
| более 50 мг / литр | около 30 мг / литр | менее 15 мг / литр | |
| 2 | рН 6,1 | рН 6,4 | рН 6,7 |
| 5 | рН 6,4 | рН 6,7 | рН 7,1 |
| 10 | рН 6,7 | рН 7,1 | рН 7,4 |
| 20 | рН 6,9 | рН 7,4 | рН 7,7 |
Наиболее рекомендуемая доза углекислого газа составляет 20-30 мг / л, и ее необходимо поддерживать для обеспечения роста растений. Также важно, чтобы количество света находилось в пределах 0,5 Вт, чтобы растения могли использовать CO 2 в процессе фотосинтеза.
2. Параметры воды и способы их изменения
2.1. рН воды и контроль
Химические соединения, растворенные в воде, влияют на ее pH, измеряемый фактором pH. В большинстве случаев подходящая вода имеет нейтральный рН, т.е. рН = 7. PH воды можно очень точно измерить с помощью pH-метра (однако это дорогое устройство при покупке), менее точно — с помощью цветовых индикаторов в виде растворов (например, бромтимоловый синий — диапазон pH 6,2-7,6, метиловый красный — диапазон). pH 4.2-6.3, однако, не очень практичные методы), доступные в зоологических магазинах с гистограммами (их преимущество в том, что помимо pH также указывают другие параметры воды, например: уровень углекислого газа, жесткость воды, нитриты, нитраты и другие) или с pH (целлюлоза, лакмус или другой, пропитанный красителем). На практике мы чаще подкисляем водопроводную воду (необходимую для размножения определенных видов), чем ее щелочную. Понижение рН воды можно получить, пропустив ее через фильтр, наполненный торфом из торфа или ольхи (при снижении рН до 6-6,5 следует помнить, что фильтрованная вода должна быть предварительно размягчена). Конечно, в зоомагазинах есть и готовые подкисляющие вещества. Для повышения рН воды можно использовать готовые препараты, доступные в аквариумных магазинах или карбонат натрия. Чтобы снизить pH, воду можно смешать с дистиллированной водой или фильтром обратного осмоса, который отделяет соли от воды, дающей мягкую воду. Для повышения рН воды можно использовать готовые препараты, доступные в аквариумных магазинах или карбонат натрия. Чтобы снизить pH, воду можно смешать с дистиллированной водой или фильтром обратного осмоса, который отделяет соли от воды, дающей мягкую воду. Для повышения рН воды можно использовать готовые препараты, доступные в аквариумных магазинах или карбонат натрия. Чтобы снизить pH, воду можно смешать с дистиллированной водой или фильтром обратного осмоса, который отделяет соли от воды, дающей мягкую воду.
Вы также можете использовать сушеные шишки черной ольхи, из которых мы готовим отвар (залить кипятком и держать под крышкой, пока он не остынет) или использовать в качестве вклада во внутренний или внешний фильтр. Трудно определить правильное количество, поэтому вы должны внимательно следить за значением pH. В среднем используется 8-13 конусов на 100 л аквариумной воды.
Мы никогда не меняем параметры воды, если в ней есть рыба. Также важно не переусердствовать, то есть лучше менять pH слишком мало, чем слишком сильно. Внезапные изменения параметров воды при этом рН могут нанести вред обитателям аквариума, поэтому мы делаем их поэтапно.
2.2. Жесткость воды KH и GH
Как известно, карбонатная жесткость (переходная) KH удаляется кипящей водой. Другое в воде, среди других Сульфаты кальция и магния (неуловимая жесткость) могут быть удалены с помощью соответствующих ионообменников. Сумма обеих твердостей называется общей твердостью GH, которая выражается в немецких градусах (1 градус соответствует 10 мг оксида кальция CaO или магния MgO, содержащихся в 1 литре воды).
| Описательная шкала для воды | Общая твердость GH [ºniem.] |
|---|---|
| Очень мягкий | 0-5 |
| мягкий | 5-10 |
| Средний жесткий | 10-20 |
| жесткий | 20-30 |
| Очень тяжело | выше 30 |
Ионообменники (иониты) удаляют соли (катионы и анионы) из воды. В аквариумистике используются катиониты (пористый материал или гель имеют кислотные свойства, которые при активации принимают отрицательный заряд и способны связывать катионы, в нашем случае кальций и магний). Каждый теплообменник имеет определенную ионную емкость (количество ионов, поглощенных на его поверхности), и после истощения его следует регенерировать (катионообменники регенерируют раствором хлорида натрия — NaCl). Обменники работают эффективно при медленном потоке воды и всегда должны быть под водой. В зоомагазинах также имеются готовые химикаты для смягчения воды. Жесткость воды можно определить лабораторными методами (весовой метод, мыльный метод — Кларк, методы титрования) и тестерами, доступными в нефтехимических магазинах.
3. Другие соединения, найденные в воде, подлежат контролю
3.1. Нитраты, нитриты и аммиак
Это соединения, вредные для рыб, концентрация которых должна строго контролироваться. Особенно опасны нитриты и аммиак, которые разрушаются в фильтре нитрифицирующими бактериями до нитратов, используемых растениями в процессе фотосинтеза. Эти соединения возникают из остатков пищи, мертвых частей растений и вводятся в аквариум вместе с экскрементами рыб. Соединения аммония вызывают повышение рН. Избыток аммиака может вызвать торможение роста растений.
Избыток азотистых соединений возникает из-за обрезки, накопления избыточного ила, рыбного помета и разложения растений и остатков пищи. Отсутствие регулярных изменений воды в аквариуме и неправильная фильтрация также влияют на концентрацию азотных соединений в воде.
Чтобы предотвратить это, регулярно заменяйте немного воды (каждые 2 недели около 25% воды), кормите рыбу меньшими порциями (чтобы корм не падал на дно и не гнил), регулярно чистите фильтры (желательно со сменой воды — фильтр лучше промыть в удаленной воде из аквариума не уничтожать бактериальную фауну, поддерживающую процесс фильтрации). Никогда не мойте фильтр в водопроводной воде) и не перебивайте аквариум (1 см рыбы = 1 литр воды). Вы также можете ввести больше растений, которые будут использовать нитраты для фотосинтеза, эффективно уменьшая их количество в воде.
3.2. хлор
Хлор — это соединение, используемое при обработке водопроводной воды (водопроводной воды). Он используется для уничтожения бактерий. Он также используется для дезинфекции воды в бассейнах. Как известно, избыток хлора в бассейне может обжечь кожу человека. То же самое происходит с рыбами, когда мы пропускаем их прямо в аквариум с водой, выливаемой из крана и не обработанной (не выделяющейся). Количество хлора можно проверить с помощью тестеров, доступных в магазинах. Чтобы удалить его из воды, вы можете использовать готовые препараты, называемые антихлоритами, или выдерживать воду от нескольких до нескольких часов.
3.3. фосфаты
3.4. железо
И избыток, и недостаток вредны. Избыток вредит рыбе и некоторым растениям, а недостаток вызывает пожелтение листьев растений. Чтобы повысить уровень железа в воде, вы можете использовать Chelat Fe. Чтобы уменьшить его количество, мы заменим часть воды.
4. Заявление о допустимых концентрациях соединений в воде
Ниже приведен список приемлемых и опасных количеств для соединений, описанных выше.
| имя | Рекомендуемое количество [мг / литр] | Опасное количество [мг / литр] |
|---|---|---|
| Диоксид углерода СО 2 | 10-15 | более 50 |
| Кислород 0 2 | 5 | менее 2 |
| NH 3 Аммиак | 0 | выше 1 |
| Нитрат NO 3 | 5-10 | более 50 |
| NO 2 нитриты | 0 | выше 0,2 |
| PO 4 фосфаты | 0,5 | выше 3-4 |
| железо | 0,1 | выше 1,5-2 |
Основные параметры воды (кратко)
Здесь рассмотрены вкратце основные параметры воды без каких-либо объяснений.
В большинстве случаев достаточно знать название этих параметров и способы их измерения для успешного содержания аквариума. Просто принимайте их как то, что вам надо контролировать — например, как вы знаете, что в розетке должно быть определенное напряжение, хотя много народу плохо себе представляет, что такое напряжение. Но это не мешает им успешно пользоваться электричеством.
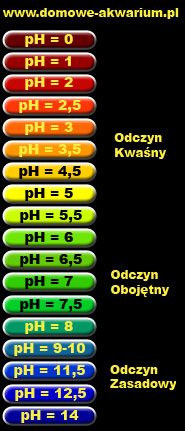
pH — характеризует кислотность воды. Должна быть в пределах 6-7.5 для большинства рыб. Наиболее важный химический параметр воды. Для измерения используются тесты, которые продаются в аквариумных магазинах. Со временем, из-за накопления органики в воде, значение рН уменьшается, поэтому за ним надо регулярно следить. Изменить это значение можно путем добавления пищевой соды (для увеличения) или специальными химикатами, продающимися в аквариумном магазине. Помните, что рыбы способны адаптироваться к другим значениям рН (в разумных пределах), если только рН изменяется плавно.
Жесткость воды — бывает постоянной (GH) и переменной (карбонатная — KH). Измеряется тестами, продающимися в аквариумном магазине. Единица измерения — градусы жесткости (dGH, dKH) или в mg/l CaCO3:
1 градус жесткости равен 17.8 mg/l CaCO3
Карбонатная жесткость (точнее, буферная способность — но это неважно, поскольку все аквариумные тесты измеряют ее, а не KH) характеризует способность воды противостоять падению pH.
Увеличение жесткости — одна чайная ложка на 50 литров воды увеличит KH примерно на 4 градуса, две чайные ложки карбоната кальция на 50 литров воды увеличат одновременно KH и GH на 4 градуса.
Ниже приведены значения кислотности и жесткости для некоторых видов рыб:
Рыбы амазонского региона (дискус)
Кислотность pH 5.5-6.5
Общая жесткость dGH 1-4
Цихлиды из западной Африки (криб)
Кислотность pH 6.0-7.0
Общая жесткость dGH 5-12
Харациновые и барбусы
Кислотность pH 6.0-7.5
Общая жесткость dGH 5-12
Лабиринтовые (гурами)
Кислотность pH 6.5-7.5
Общая жесткость dGH 5-10
Центрально-американские цихлиды (акара, северум)
Кислотность pH 6.5-7.5
Общая жесткость dGH 10-20
Живородящие (гуппи, меченосцы)
Кислотность pH 7.5-8.5
Общая жесткость dGH 15-25
(+)чуть подсоленная вода
Моллинезии
Кислотность pH 7.5-8.3
Общая жесткость dGH 20-30
(+подсоленная вода, 2-3 чайных ложки на 10 литров воды)
Африканские цихлиды из озера Малави
Кислотность pH 7.7-8.5
Общая жесткость dGH 10-15
Африканские цихлиды из озера Танганьика
Кислотность pH 8.5-9.3
Общая жесткость dGH 10-15
Многие рыбы способны адаптироваться и к другой воде, например, дискусы могут быть акклиматизированы к более жесткой воде. Но если вы хотите получить потомство от рыб, то лучше обеспечить параметры воды оптимальные для данного вида рыб, их обычно можно найти в справочнике.
Помните, что рыбы лучше себя чувствуют, если параметры воды отличаются от оптимальных (конечно в разумных пределах), но стабильны. Поэтому не старайтесь резко изменить их. Если вы это делаете — то делайте понемногу, не более 1-2 градуса кислотности в день.
С другой стороны, постарайтесь узнать, какая воды течет у вас из крана. Этим вы облегчите себе жизнь. Гораздо проще увеличить жесткость воды (например, для цихлид из озера Танганьика), обратное сделать сложнее — нужна фильтрация воды через ионообменные смолы и т.д. Поэтому подумайте вначале, сможете ли вы это делать в течении долгого времени, прежде чем заводить дискусов, если у вас из крана течет артезианская вода, которая напоминает Танганьику.
Основные физико-химические параметры морской аквариумной воды
Как известно, вода (оксид водорода) представляет собой неорганическое соединение, состоящее из двух атомов водорода и одного атома кислорода, которые соединены между собой ковалентной связью (объединятся электронные облака входящих в соединение атомов). Обозначается химической формулой Н2О. При нормальных условиях (20ОС, 1 атм.) является жидкостью, не имеющей цвета, запаха и вкуса. Молекулярная структура молекулы воды напоминает равнобедренный треугольник, в основании которого два атома водорода, а на вершине атом кислорода. При этом общее электронное облако сдвинуто в сторону кислорода, придавая молекуле высокую полярность. По этой причине вода является хорошим сильнополярным растворителем.
Для оценки физико-химических параметров морской воды и роли входящих в ее состав различных компонентов целесообразно рассмотреть понятие концентрации и единиц ее измерения. Концентрация — это величина, характеризующая количественный состав раствора. Она может измеряться соотношением количества растворенного вещества, выраженного в единицах массы (например, декаграмм, грамм, миллиграмм, микрограмм) к массе раствора, выраженной в килограммах. Единицами измерения концентрации являются:
Другой формой выражения концентрации является отношение массы растворённого вещества к объёму раствора. Тогда единицами измерения концентрации являются даг/л, г/л, мг/л, мкг/л. При малых концентрациях 1 мг/л становится почти равным 1 ppm, однако при увеличении концентрации отличия единиц, привязанных к весу раствора и объему раствора, становятся заметнее.
Также для выражения концентрации используется отношение моля растворенного вещества к объему раствора моль/л, где моль – это количество вещества, масса которого, выраженная в граммах, численно равна молекулярной массе.
Водородный показатель РН и окислительно-восстановительный потенциал
При нормальных условиях вода слабо диссоциирована, т.е. имеет в своем составе распавшиеся части молекулы Н2О : ионы водорода Н+ и гидроксильные ионы ОН-. Доля этих ионов по сравнению с долей недиссоциированных молекул воды очень мала и измеряется величинами порядка миллиардных долей. Но именно наличие этих ионов и их количество придает водным растворам кислотность или щелочность. Для количественной оценки наличия ионов водорода существует водородный показатель РН, который представляет собой отрицательный десятичный логарифм молярной концентрации ионов водорода. В нейтральной среде, где концентрация ионов водорода равна концентрации гидроксильных ионов, показатель РН равен 7. Это означает, что на один моль водорода приходится 10 миллионов литров раствора. А изменение этого показателя в ту или иную сторону всего на одну единицу свидетельствует об изменении концентрация ионов водорода в десять раз, на две единицы – в сто раз, три – в тысячу раз и т.д.
Важнейшими процессами, протекающими в аквариумной системе и обеспечивающими создание необходимых условий содержания гидробионтов, являются окислительно-восстановительные реакции, т.е. реакции, связанные с передачей или присоединением электронов.
Способность веществ отдавать или присоединять электроны определяется их окислительно-восстановительной способностью. Она заключается в том, что одни вещества, отдавая свои электроны и заряжаясь положительно, окисляются, а другие, принимая электроны и заряжаясь отрицательно – восстанавливаются. Разность электрических потенциалов между ними представляет собой окислительно-восстановительный потенциал (ОВП) или РЕДОКС-потенциал. Различные вещества обладают разной окислительно-восстановительной способностью. Так, наиболее активным окислителем является кислород, а восстановителем – водород.
Жизнь аквариума так устроена, что со временем восстановители накапливаются, а окислители расходуются. Поэтому измерение ОВП, по величине которого можно судить о наличии в системе окислителей и восстановителей и о приемлемости среды для жизни гидробионтов, имеет большое значение. ОВП измеряется путем погружения специального электрода в воду. При этом, если в воде много восстановителей, то они отдают электроду свои электроны, давая ему отрицательный заряд. Если в воде много окислителей, то наоборот, они придерживают свои электроны, принимая на себя электроны электрода, придавая ему, тем самым, положительный заряд. Заряд электрода можно измерить и это будет показателем ОВП. Единицами измерения являются милливольты Мв. Надо учитывать, что этот заряд зависит не только от наличия окислителей и восстановителей, но и от величины рН и температуры. В принципе, в аквариумных системах, где рН и температура являются сравнительно постоянными величинами, то поправки рН на температуру можно не учитывать.
В практике морской аквариумистики ОВП, в основном, используется там, где применяются озонаторы и денитрификаторы.
Взаимодействие морской воды с кислородом и углекислым газом
Кислород и углекислый газ играют важнейшую роль в создании условий для обеспечения жизнедеятельности морских организмов. Поэтому, необходимо рассмотреть вопросы взаимодействия этих двух газов с морской водой.
В воздухе содержится 21 процент кислорода и 0,03-0,04 процента углекислого газа. Т.е. по содержанию в воздухе кислород превышает углекислый газ более чем в 500 раз. Но растворяется в воде углекислый газа в 30-40 раз лучше, чем кислород. Поэтому в воде их концентрации сближаются. И тот и другой газ проникают сквозь поверхность воды в прямом и обратном направлении в зависимости от того перенасыщен раствор углекислым газом или кислородом. Надо учитывать, что с повышением температуры растворимость газов в воде уменьшается. Необходимо отметить, что активную роль в процессах газового обмена играют живые организмы. Животные, а также растения в темной фазе поглощают кислород, выделяя при этом углекислый газ. Выделение кислорода и поглощение углекислого газа осуществляется растениями в светлое время в результате фотосинтеза.
Карбонатный буфер
Карбонатный буфер или, как его еще называют карбонатно-бикарбонатный буфер, обеспечивает поддержание в морской воде стабильного уровня рН, в среднем около 8-8,2. В формировании этого буфера принимают участие растворенный углекислый газ и присутствующие в воде ионы кальция и магния.
Их взаимодействие заключается в следующем. Образовавшиеся во время растворения углекислого газа карбонат ионы и бикарбонат ионы вступают во взаимодействие с находящимися в воде катионами кальция и магния. Гидрокарбонаты кальция и магния являются растворимыми в воде соединениями, и их наличие является обычным делом, не создающим особых проблем. А карбонаты кальция и магния – это нерастворимые соединения, которые могут выпадать в осадок в виде взвеси и в морских аквариумах могут приносить определенные неудобства в виде нежелательных отложений. Гидрокарбонаты кальция или магния находятся в равновесии с карбонатами этих металлов. Необходимо отметить, что большое количество карбоната кальция в море является продуктом жизнедеятельности живых организмов, представленном в виде каркасов кораллов, коралловых рифов, раковин моллюсков и других известковых образований.
Если, например, рН воды уменьшается, т.е. среда становится кислой с повышенным содержанием ионов водорода, то равновесие между угольной кислотой, гидрокарбонат ионом (бикарбонатом) и карбонат ионом сдвигается в сторону угольной кислоты. Ее становится в избытке, и она разлагается на воду и углекислый газ, который выделяется в атмосферу. При этом также сдвигается равновесие между карбонатами и гидрокарбонатами металлов в сторону гидрокарбонатов. В итоге происходит восстановление рН до начального нейтрального уровня.
С другой стороны, если система защелачивается, и в ней уменьшается количество ионов водорода, то смещение цепочки равновесий происходит в обратную сторону, и оно сопровождается дополнительным поглощением углекислого газа из атмосферы и выделением большего количества нерастворимых карбонатов кальция и магния. При этом также происходит восстановление рН до первоначального уровня.
Так как, и углекислый газ в атмосфере, и известняк в океане содержатся в достаточном количестве, то это является гарантией работоспособности карбонатно-бикарбонатного буфера.
Проиллюстрировать процессы, происходящие при работе карбонатно-бикарбонатного буфера, можно на нижеприведенном рисунке.
Содержание в воде кальция и магния
Кальций является важнейшим элементом в обеспечении жизнедеятельности гидробионтов в мировом океане. В океанических водах кальция содержится примерно 420 мг/л. Содержание его в воде морского аквариума находится в диапазоне 380-450 мг/л. Также в воде присутствует магний. Его количество больше (1250-1350 мг/л), но в биологических и химических процессах, протекающих в океане и в морских аквариумных системах, кальций участвует в большей степени. Кальций и магний, в первую очередь, определяют такие свойства морской воды, как щелочность и карбонатная жесткость. Под щелочностью морской воды понимается свойство морской воды, связанное с содержанием в ней анионов слабых кислот и катионов эквивалентных этим кислотам. Численно она определяется количеством сильной кислоты, добавляемой в систему, достаточной для того что бы «сломать» карбонатный буфер и довести рН до величины 5,5-5,7.
Данное понятие щелочности морской воды (Alkalinity) является количественным показателем и отличается от понятия щелочной реакции среды, определяемой показателем рН. Единицы определения щелочности мгэкв/л. В природной морской воде этот показатель колеблется от 2,5 до 3,5 мгэкв/л., который может быть рекомендован для рифовых аквариумов.
Соленость
Электропроводность
Измеряется в морской воде в миллисименсах. Связана с соленостью воды. Используется в различном автоматическом оборудовании для контроля солености воды. Для замера используются приборы кондуктометры. Принцип действия прибора основан на прямой зависимости электропроводности воды (силы тока в постоянном электрическом поле, создаваемом электродами прибора) от количества растворенных в воде соединений. Позволяют измерять электропроводность любой воды, от пресной до сверхсоленой.
© Аква Лого
Евгений Константинов