Неполная редукция тимуса что это
Что нужно знать о патологии тимуса
Внутренний секрет
Вилочковая железа — источник популяции тимусзависимых лимфоцитов (Т-лимфоцитов), которые отвечают за распознавание антигенов, регуляцию и другие функции иммунного ответа. Именно в тимусе происходит их клонирование и дифференцировка. Для обеспечения защиты созревающих Т-лимфоцитов от воздействия разнообразных антигенов даже существует гемато-тимусный барьер.
Еще одной особенностью вилочковой железы является ее «недолговечность» — с пубертатного периода начинается инволюция, и у взрослых практически вся железистая ткань заменяется жировой.
Значимость этой железы трудно переоценить. При ее недоразвитии происходит снижение клеточного и гуморального иммунитета, в следствие чего возникают септические осложнения в первую очередь вирусной и грибковой природы. В детском возрасте возможно и увеличение вилочковой железы (тимомегалия), которое часто сопровождается экссудативно-катаральным диатезом, тяжелым и длительным течением бронхолегочных заболеваний. Правда, следует учитывать возможность частого физиологического увеличения вилочковой железы на первом году жизни, которое может наблюдаться почти у половины детей.
Отдельно стоят болезни тимуса у взрослых. В большинстве случаев речь идет о различных опухолях вилочковой железы, которые носят общее название — тимомы. Они являются наиболее частыми новообразованиями средостения (комплекс органов, расположенных между правой и левой плевральными полостями), хотя и составляют менее 1 % всех онкологических заболеваний. Чаще всего встречаются доброкачественные образования (65—70 %), но и они могут доставлять большие проблемы больному. Правда, на начальных стадиях и при медленном росте эти опухоли не сопровождаются какими-либо патологическими симптомами, поэтому выявить их можно только случайно, при компьютерной томографии грудной клетки. Однако значительное увеличение объема патологически измененной вилочковой железы приводит к сдавлению и нарушению функции близлежащих органов. Поскольку тимус расположен в средостении, за грудиной, его ближайшими «соседями» являются трахея, пищевод, сердце, аорта, легочная артерия, большая полая вена и нервные волокна.
Характерные симптомы при развитии опухоли тимуса — затруднение дыхания и глотания, кашель, отеки и цианоз верхней части туловища и лица, боль за грудиной, шум и тяжесть в голове, возможен сбой сердечного ритма. Нарушение работы тимуса, которое возможно даже при доброкачественном течении опухоли, часто приводит к развитию миастении — нарушению функции мускулатуры тела. Это нервно-мышечная патология, которая имеет аутоиммунную природу и сопровождается быстрой слабостью и утомляемостью в первую очередь скелетных мышц. Больному человеку трудно встать со стула, подняться по лестнице, руки становятся «ватными». Усталость нарастает к вечеру: нарушается речь, опускаются веки, появляется двоение в глазах, сложно сфокусировать взгляд. При выраженной симптоматике нарушается процесс жевания и глотания, изменяется голос (становится гнусавым). Характерна связь физической нагрузки одних групп мышц с нарушением других функций мышечной системы. Так, после некоторого усилия слабость ощущается не только в мышцах, которые были задействованы, но и во всех остальных. Для злокачественных опухолей, особенно на поздних стадиях, характерны отдаленные метастазы и нарастающая интоксикация.
Лечение болезни комплексное, после хирургической операции назначается лучевая и химиотерапия. Оперативные вмешательства в настоящее время могут в ряде случаев проводиться эндоскопически (торакоскопия), что позволяет значительно сократить послеоперационный период. Современные методы лечения позволяют вернуть здоровье в 60—90 % случаев в зависимости от степени развития патологии.
ЗАБОЛЕВАНИЯ ВИЛОЧКОВОЙ ЖЕЛЕЗЫ И ИХ ЛЕЧЕНИЕ
В. Л. Маневич, В. Д. Стоногин, Т. Н. Ширшова, И. В. Шуплов, С. В. Момотюк
Публикация посвящается памяти Василия Дмитриевича Стоногина (1933-2005)
Заболевания вилочковой железы изучаются врачами различных специальностей: невропатологами, эндокринологами, иммунологами, гемато¬логами, хирургами, патогистологами и др. Проблема миастении является относительно изученной; в последние годы установлено участие вилочковой железы в таком жизненно важном процессе, как выработка (регулировка) иммунитета.
Опухоли и кисты вилочковой железы, миастения и некоторые аутоиммунные заболевания требуют хирургического лечения. Значительный вклад в этот сложный раздел внесли отечественные и зарубежные хирурги (А. Н. Бакулев и Р. С. Колесникова; В. Р. Брайцев; Б. К. Осипов; Б. В. Петровский; М. И. Кузин и соавт.; С. А. Гаджиев и В. Васильев; Viets, и др.).
Из 66 больных 65 были оперированы: 62 произведена радикальная и 3 эксплоративная операция.
Клиника миастении хорошо известна, однако правильный диагноз больному с миастенией нередко ставят после продолжительного наблюдения. У 32 из 44 наших больных правильный диагноз был поставлен только через 6-8 месяцев после появления первых признаков заболевания. Это объяс¬няется малой выраженностью клинической картины миастении в начальной стадии и плохой осведомленностью практических врачей, к которым впервые обращаются за помощью больные миастенией (невропатологи, окулисты, отоларингологи, терапевты).
При выраженной генерализованной форме миастении диагноз не труден. В начальной стадии и в случаях, когда миастения носит локализован¬ный характер (бульбарная, глазная, скелетно-мышечная, глоточно-лицевая), у наших больных предполагались самые разнообразные диагнозы, вплоть до подозрения на симуляцию. Считаем необходимым подчеркнуть особую важность прозериновой пробы, имеющей дифференциально-диагностическое значение. У больных миастенией внутримышечная инъекция 1-2 мл 0,05% раствора прозерина устраняет мышечную слабость и быструю утомляемость, в то время как при миопатиях и мышечной слабости, вызванных другими причинами, инъекция прозерина не дает эффекта. Имеют значение динамометрия, эргометрия и электромиография.
Общепризнано, что лечение миастении должно проводиться комплексно с участием 3-4 специалистов: невропатолога, терапевта-эндокринолога, анестезиолога-реаниматолога и хирурга. На основании большого клинического материала (сотни оперированных и наблюдаемых в отдаленном периоде) авторы подчеркивают преимущество оперативного лечения миастении перед консервативным (М. И. Кузин; А. С. Гаджиев и соавт., и др.). Результаты оперативного лечения лучше, если операцию производят впервые 2-2,5 года от начала заболевания. В более поздние сроки операция оказывается менее эффективной. Отсюда вытекает особая важность ранней диагностики миастении.
Наличие у больного выраженной клинической картины прогрессирующей миастении является показанием к операции, так как все консервативные методы лечения, включая и рентгенотерапию, дают лишь временное улучшение.
Вопрос о необходимости предоперационной рентгенотерапии нельзя считать окончательно решенным. Только 5 из наших больных перед операцией получали рентгеновское облучение, причем каких-либо улучшений в течении послеоперационного периода мы у них не отметили. У больных, оперированных по поводу злокачественной тимомы с явлениями миастении, предоперационное облучение играет важную роль в ближайшем исходе операции и в какой-то степени влияет на сроки наступления рецидива заболевания (М. И. Кузин и соавт.).
Большинство операций по поводу миастении нами выполнено из переднего доступа путем полной срединной продольной стернотомии. Наиболее ответственным моментом операции является отделение железы от левой плечеголовной вены. Ранение этого сосуда опасно из-за массивного кровотечения и возможной воздушной эмболии. В одном случае произошло ранение этой вены, закончившееся благополучно (был наложен боковой сосудистый шов). При операции следует избегать наложения зажимов на железистую ткань, раздавливания её.
У 3 наших больных было сочетание миастении и загрудинного зоба. Произведены тимэктомия и субтотальная струмэктомия.
У 26 больных во время операции была повреждена медиастинальная плевра, в том числе у 8 больных с обеих сторон. Осложнений, связанных с операционным пневмотораксом, не было. Если во время операции плевра не повреждена, переднее средостение дренируется одной резиновой трубкой, конец которой выводят в нижний угол раны или через отдельный прокол ниже мечевидного отростка и соединяют с отсосом. Вслед за тимэктомией трахеостома (превентивно) была наложена 5 больным.
Если сама операция тимэктомии по сравнению с другими торакальными операциями не представляет особой сложности, то течение послеоперационного периода у ряда больных сопровождается осложнениями, на 1-м месте среди которых стоит миастенический криз. Поэтому операции по поводу миастении возможны только в тех учреждениях, где можно обеспечить круглосуточное наблюдение анестезиолога-реаниматолога, а также многодневную аппаратную вентиляцию лёгких.
Вопрос о назначении антихолинэстеразных препаратов в послеоперационном периоде окончательно не решен. С целью уменьшения гиперсекреции бронхов лучше назначать прозерин с небольшими дозами атропина.
Тяжелый миастенический криз с расстройством дыхания, сердечной деятельности, глотания и т. д. наблюдали в первые дни после операции у 26 больных. Вывести из криза консервативными мероприятиями удалось 7 больных; 19 больным была наложена трахеостома с переводом их на аппаратное дыхание, длительность которого составляла от 3 до 40 суток. Через трахеостому систематически круглосуточно аспирируют слизь из трахеобронхиального дерева. Питание больных, находящихся на аппаратном дыхании, осуществляется через зонд. Помимо медикаментозного лече¬ния, применения кислорода, использования дыхательной гимнастики, в последние годы всем больным миастенией в послеоперационном периоде проводится лечебный массаж всего тела, повторяемый несколько раз в день.
Трахеостомическую трубку удаляют после того, как у больного стойко восстанавливается самостоятельное дыхание.
Среди наших больных мы наблюдали 3 (2 мужчин и 1 женщину, все старше 40 лет) с липотимомой. У них опухоль была небольших размеров, с ровными четкими границами; опухоль была расценена нами как доброкачественная. Заболевание сопровождалось умеренно выраженными явлениями миастении. Один из этих больных поступил с жалобами на слабость и быструю утомляемость; при дальнейшем обследовании у него была выявлена тяжелая гипопластическая анемия. Больной оперирован; в ближайшем послеоперационном периоде отмечены благоприятные результаты.
Из 15 наших больных с доброкачественными тимомами у 9 (4 мужчин и 5 женщин) были явления миастении, у остальных опухоль ничем себя не проявляла и была выявлена случайно.
Больной М., 19 лет, поступил 17.III.1966 года. Жалоб нет. После окончания средней школы при прохождении медицинского обследования для поступления в учебное заведение у него рентгенологически было выявлено опухолевое образование в переднем средостении. Признаков миастении нет. Пневмомедиастинография: в переднем средостении со всех сторон окутанное газом образование продолговатой формы размером 15*5 см, с участками просветления в центре; заключение: опухоль вилочковой железы, возможно, с участками распада. Произведена тимэктомия. Гистологически: злокачественная тимома ретинулоклеточного типа. Проведена послеоперационная рентгенотерапия. Осмотрен через 4 года после операции:, жалоб нет, состояние хорошее, признаков рецидива нет.
Дифференциальный диагноз доброкачественных и злокачественных тимом нередко бывает трудным. Злокачественная тимома по рентгенологическим признакам напоминает лимфогранулематоз и лимфосаркому. В отличие от этих образований тимома располагается непосредственно за грудиной, обычно бывает овально-сплющенной или конусовидной формы. Всякая тимома, протекает она с явлениями миастении или без них, подлежит удалению, В литературе имеются указания, что каждую тимому следует рассматривать как потенциально злокачественную опухоль (Б. В. Петровский; Seybold и соавт., и др.).
Вопрос о возможности изолированного поражения вилочковой железы лимфогранулематозом представляется спорным. Мы наблюдали 2 больных, у которых до операции был установлен диагноз “опухоль вилочковой железы”. После операции, при гистологическом исследовании препаратов, диагноз был изменен: изолированное поражение лимфогранулематозом вилочковой железы. Принимая во внимание указания о возможности изолированного поражения вилочковой железы на ранних стадиях заболевания (С. А. Гаджиев и В. В. Васильев), оба эти наблюдения мы отнесли к патологии вилочковой железы. После операции за больными ведётся наблюдение в течение 5 лет. Признаков рецидива и генерализации процесса нет.
Заболевание, заключающееся в сочетании патологии вилочковой желе¬зы и гипопластической анемии, которая возникает вследствие избирательного поражения костного мозга без изменения продукции лейкоцитов и тромбоцитов, впервые описано Кацнельсоном в 1922 году. Позже было предположено, что вилочковая железа влияет на гемопоэтическую функцию костного мозга, регуляцию состава белковых фракций, состояние лимфоидной системы и т. д. (Soutter и соавт.). С тех пор опубликованы данные некоторых авторов об отдельных операциях на вилочковой железе при различных болезнях крови (А. Н. Бакулев, 1958; Chaemers и Boheimer, и др.). К настоящему времени нами произведены 4 операции тимэктомии у больных гипопластической анемией. О результатах этих операций говорить пока рано, так как после них прошел небольшой срок. Ближайшие результаты удовлетворительные у 3 больных.
1) Бакулев А. Н., Колесникова Р. С. Хирургическое лечение опухолей и кист средостения. М., 1967.
2) Брайцев В. Р. Врожденные дизонтогенетические образования средостения и легких. М., 1960.
3) Гаджиев С. А., Догель Л. В., Ваневский В. Л. Диагностика и хирургическое лечение миастении. Л., 1971.
4) Гаджиев С. А., Васильев В. Мед газета, 1973, №15.
5) Кузин М. И. Клин мед, 1969, № 11, с. 6.
6) Кузин М. И., Успенский Л. В., Волков Б. П. Вести, хир., 1972, №7, с.48.
7) Осипов Б. К. Хирургические заболевания легких и средостения. М., 1961.
8) Петровский Б. В. Хирургия средостения. М., 1960.
9) Andгus W., Fооt N., J. thorac. Surg., 1937, v. 6. p. 648.
10) Chaemers G., Boheimer K., Brit. med. J., 1954, v.2, p.1514.
11) Pope R., О s g о о d R., Am. J. Path., 1953, v. 20, p. 85.
12) S е у b о 1 d W., D о n a 1 d М. С., J. thorac. Surg. Clagett C. et al., 1950, v. 20, p.195.
13) Soutter G., Sommers Sh. R e 1 m о n Ch. et al. Ann. Surg., 1957, v. 146, p. 426.
14) Viets H., Brit. med. J., 1950, v. 1, p.139.
| 1) Виктор Львович Маневич – профессор, доктор медицинских наук, 2-я кафедра клинической хирургии ЦОЛИУв. |  |
| 2) Василий Дмитриевич Стоногин – доцент 2-й кафедры хирургии ЦОЛИУв, заведующий учебной частью кафедры, кандидат медицинских наук. E-mail: svas70@mail.ru |  |
Любое копирование материала запрещено без письменного разрешения авторов и редактора.
Работа защищена Федеральным законом о защите авторских прав РФ.
Наивные Т-клетки — ключ к долголетию
Наивные Т-клетки — ключ к долголетию
Автор
Редактор
Статья на конкурс «био/мол/текст»: Наивные Т-лимфоциты могут поведать о том, что вы хотели бы скрыть. Впервые было осуществлено секвенирование профиля Т-клеточных рецепторов периферической крови человека. Успехи в развитии технологий секвенирования нового поколения дают возможность проследить за динамикой колебаний численности и разнообразия наивных Т-клеток по мере старения организма. Вместе с этими знаниями появляется ответ на вопрос, почему женщины живут дольше мужчин, и приходит мысль о том, что увеличить продолжительность жизни можно, используя собственные Т-клетки. «Иммунологические часы» несложно обмануть, пойдя на хитрость.
Обратите внимание!
Эта работа опубликована в номинации «лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Всегда ли можно дать сорокалетнему мужчине его сорок? А пятидесятилетнему? А скольким тридцатилетним женщинам вы бы не дали двадцати? Определять возраст человека по внешней составляющей не самая лёгкая задача. Однако, людям, перешагнувшим определённый порог, различный для мужчин и женщин, когда репродуктивная функция начинает стремительно угасать, становится сложнее скрывать свой возраст.
Для внутренних процессов человеческого организма характерны совершенно иные темпы изменений. «Возрастной порог» нашей иммунной системы расположен гораздо ближе к детству, чем к старости. Уже с первого года жизни в тимусе ребёнка начинают происходить драматические изменения: функциональная ткань органа заменяется на соединительную, уменьшаясь каждый год на 3% до 35–45 лет, а после 45 — на 1% (рис. 1). В 70 лет соединительная ткань занимает 90% тимуса [1]. Наиболее активно тимус функционирует в пренатальный период и до наступления половой зрелости. За это время происходит наработка максимальных возможностей Т-клеточного иммунитета, что будет во многом определять эффективность иммунного ответа человека на протяжении всей его жизни.
Рисунок 1. Сравнение размеров тимуса у новорождённого (а) и взрослого (б). К 50 годам тимус уменьшается в 5-7 раз по сравнению с первоначальным размером. Рисунок с сайта my.bpcc.edu.
Тимус — военная база иммунной системы
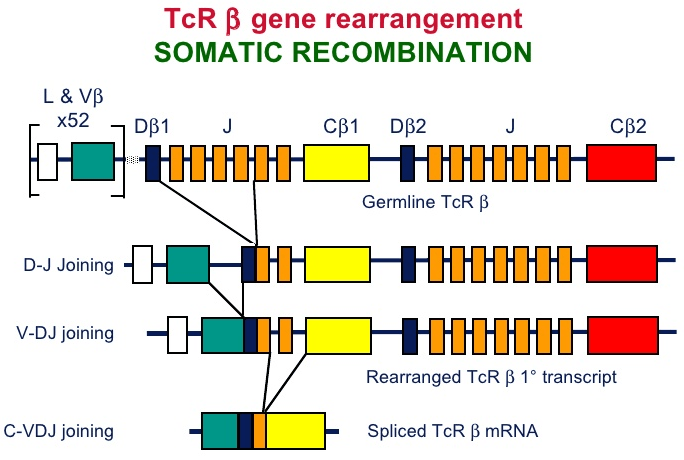
В тимусе иммунная система обучает своих «солдат». Предшественники Т-лимфоцитов размножаются в костном мозге и с кровью попадают в тимус. В нём происходит ключевое событие в жизни Т-клеток, определяющее их специфичность к антигену, с которым они никогда ещё не встречались — соматическая рекомбинация (также V(D)J-рекомбинация, рис. 2). Она заключается в перетасовке участков генов, кодирующих гипервариабельные участки α и β цепей Т-клеточного рецептора (TCR). С помощью TCR Т-клетки распознают «свой» антиген, к которому они специфичны, в составе главного комплекса гистосовместимости (MHC) антиген-презентирующих клеток (рис. 3). Благодаря этому процессу создаётся гигантское разнообразие TCR — около 6 × 10 5 возможных вариантов на каждые 10 6 Т-клеток [2]. В силу такой огромной вариабельности Т-клеточных рецепторов существует высокая вероятность того, что при проникновении в организм какого-либо чужеродного агента найдётся Т-клетка, TCR которой окажется специфичным именно ему. Соматическая рекомбинация происходит в кортикальной части тимуса, из неё клетки мигрируют в медуллярную часть и претерпевают негативный отбор: в экземплярах, реагирующих на собственные антигены, экспрессируемые организмом, запускается апоптоз.
Рисунок 2. Соматическая рекомбинация на примере β цепи TCR. Исходная последовательность в гене, кодирующем β цепь TCR содержит V (variable), D (diversity), J (Joining) и C (constant) сегменты. Сначала один из двух D-сегментов соединятеся с одним из 13 J-сегментов. Получившийся DJ-сегмент присоединяется к одному из 50 V-сегментов. Сегменты выбираются случайным образом, и механизм их сшивки также предполагает случайное варьирование количества пар оснований, это обеспечивает разнообразие TCR. Аналогичный процесс происходит c последовательностью, кодирующей α-цепь только без D-сегмента. Рисунок с сайта Slideshare.
Рисунок 3. Взаимодействие TCR и антиген-презентирующей клетки. а — Т-клетка (фиолетовая) взаимодействует с антиген-презентирующей клеткой (APC, синяя). б — APC презентирует антиген в составе MHC. Гетеродимер TCR состоит из α и β цепей, охватывающих MHC с антигеном. С антигеном главным образом взаимодействуют области CDR3 — это домены, отвечающие за специфичность TCR к данному антигену. Рисунок с сайта Genomemedicine.
После наступления пубертатного периода производство тимусом наивных Т-клеток резко снижается и на протяжении всей взрослой жизни человека активность этого органа остаётся на самом базальном уровне. Чем это грозит? Созданное за такой короткий период огромное разнообразие TCR действительно обеспечивает эффективный иммунный ответ на большинство потенциальных угроз. Но это разнообразие остаётся константным только некоторое время.
Мы теряем наших бойцов!
По результатам последних исследований [2], доля наивных Т-клеток как в CD4 + (Т-хелперы) так и в CD8 + (Т-киллеры) субпопуляциях периферической крови человека линейно уменьшается с возрастом. В детстве она составляет 50–80% от всего Т-клеточного пула и уменьшается на 0,75% каждый год, к 70 годам она составляет одну четверть первоначального изобилия. Авторы исследования [2] создали новый подход к использованию технологии секвенирования нового поколения компании Illumina для получения наиболее точных индивидуальных профилей репертуара TCR у людей различных возрастных групп. Было показано, что разнообразие TCR в периферической крови человека коррелирует с процентным содержанием в ней наивных Т-клеток и почти линейно уменьшается с возрастом — примерно на 5 × 10 3 вариантов TCR в год. Наивные Т-клетки сосуществуют в крови с Т-клетками памяти, клоны которых образуются в результате пролиферации наивных Т-клеток, повстречавших «свой» антиген. Размножившиеся клоны с каждым годом занимают всё большую долю доступного для пролиферации пространства в крови, это отражается на численности наивных Т-клеток, так как общее количество Т-клеток в крови человека относительно стабильно.
* — Но не стоит забывать, что кроме популяций в периферической крови, у человека есть гораздо более мощная локальная армия Т-лимфоцитов «на местах»: «Т-лимфоциты: путешественники и домоседы» [4]. — Ред.
Общее разнообразие TCR определяется количеством редких клонов в пуле Т-клеток, поэтому отсутствие возрастных изменений в разнообразии наиболее многочисленных Т-клеточных клонов указывает на то, что клоны наивных Т-клеток теряются с возрастом. Это связано с тем, что клоны наивных Т-клеток обычно малочисленны, поэтому вероятность того, что ни одна клетка данного клона не сможет поделиться или погибнет в результате каких-то случайных событий гораздо выше, чем для клонов с большим числом клеток.
Старики с высоким разнообразием TCR
Другое объяснение явления увеличения разнообразия TCR после 70 лет заключается в том, что люди этой возрастной группы уже перешагнули определённый возрастной порог, пройдя в некотором смысле проверку на прочность — уникальный набор физиологических параметров, включая особенности иммунной системы, сделал их наиболее приспособленными среди всех особей популяции в данных условиях. Из этого можно заключить, что повышенное содержание наивных Т-клеток в субпопуляции CD4 + периферической крови человека коррелирует с долгожительством. Увеличение доли наивных Т-клеток в пуле CD4+, а значит и увеличение разнообразия TCR обеспечивает лучшую иммунорегуляторную функцию, что снижает общее воспаление, усиливающееся по мере старения организма из-за активации аутоиммунных процессов, увеличивает эффективность распознавания раковых клеток и обеспечивает более сбалансированный иммунный ответ [2].
Долгая, но бездетная жизнь
Рисунок 4. Придворные евнухи в Китае. Некоторые евнухи жили более ста лет. Рисунок с сайта Lacasamundo.
Исследование о придворных евнухах династии Чозунь в Корее 2012 года [6] показало, что продолжительность жизни евнухов составляла на 15–20 лет больше, чем продолжительность жизни мужчин с нормальной репродуктивной функцией, живущих в тех же условиях (рис. 4). Возможно, их продолжительность жизни увеличивалась именно благодаря отсутствию инволюции тимуса под влиянием половых гомонов, а следовательно благодаря большему разнообразию TCR наивных Т-клеток. В пользу этой гипотезы можно привести данные о том, что у женщин производство тимусом наивных Т-клеток происходит более эффективно, чем у мужчин, и уменьшение их содержания в периферической крови у женщин выражено в меньшей степени, чем у мужской части населения [7]. Возможно, лучшая работа иммунной системы у женщин связана с тем, что во время беременности иммунитет женщины необходимо «обуздать», сделав его толерантным к фактически чужеродному телу — плоду, что требует участия сложных регуляторных путей. Высокая точность регуляции иммунного ответа очень важна, так как ошибка приведёт к потере потомства. К этим рассуждениям можно прибавить и тот факт, что у женщин с наступлением менопаузы яичники перестают вырабатывать эстрогены, а у мужчин выработка половых гормонов не прекращается. Это объясняет большую продолжительность жизни у женщин, чем у мужчин, характерную для любых национальностей. В Европе и США женщины живут дольше мужчин на 4,5–5 лет, в России — на 13 [6].
Мальчик, которому сделают орхеэктомию (удаление яичек), может быть, и получит дополнительные 10–15 лет жизни, вместе с тем лишившись возможности иметь детей и получив набор других не совсем приятных последствий. Существуют менее радикальные решения, основанные на приёме определённых препаратов, способствующих восстановлению функции тимуса. Одно из таких веществ — грелин, этот гормон вырабатывается слизистой оболочкой желудка и вызывает чувство голода, действуя на центры гипоталамуса. Оказалось, что грелин участвует в Т-клеточном сигналлинге, способен снижать связанное с возрастными изменениями воспаление, способствует восстановлению структуры тимуса и стимуляции его функций. Ряд цитокинов и факторов роста (интерлейкины 7 и 22, фактор роста кератиноцитов) являются потенциальными кандидатами для решения проблемы восстановления функции тимуса у взрослых людей. Интерлейкины обеспечивают дифференцировку и выживание тимоцитов. Фактор роста кератиноцитов необходим для пролиферации и дифференцировки функциональных тканей тимуса, его использование вызывает пролиферацию тимоцитов и увеличивает размеры органа. Возможно также использование веществ, блокирующих выработку стероидных гормонов, таких как аналоги гонадотропин-релизинг гормона, например, люпрона. Люпрон действует на гипофиз, блокируя рецепторы к гонадотропин-релизинг гормону, из-за чего уменьшается выработка лютеинизирующего и фолликуло-стимулирующего гормонов, что ведёт к снижению продукции эстрогена и тестостерона. И всё же, все вышеперечисленные вещества имеют неоднозначное воздействие на организм, и пока ещё нет данных о долгосрочных последствиях их приёма, поэтому их назначают только в случае восстановления после химиотерапии или при ВИЧ-инфекции, когда стимуляция работы тимуса необходима для реконституции иммунной системы [1].
Хранение наивных Т-клеток — полезная инвестиция в будущее
Есть ли иной способ продлить мужскую жизнь? Авторов статьи [2] посетила смелая идея решения этой проблемы. Кроме того, что редко встречающиеся клоны наивных Т-клеток в результате случайных событий теряются с возрастом, они, как и все клетки организма, могут поделиться лишь ограниченное количество раз (примерно 50 — лимит Хейфлика), что обусловлено укорочением теломерных участков хромосом после каждой репликации ядерной ДНК, а делятся наивные Т-клетки раз в 1–2 года. Значит примерно к 70 годам основная часть Т-клеток выйдет из строя. Решение есть — можно запасать наивные Т-клетки! У молодых людей в возрасте до 15–20 лет, когда процессы формирования основного пула наивных Т-клеток уже заканчиваются, нужно брать образцы крови в таком объёме, чтобы количества наивных Т-клеток в них хватило для полного восстановления их пула уже в пожилом возрасте, и заморозить. Очень важно, чтобы забор произошёл именно в этот промежуток времени. Если брать кровь у более взрослых людей, количества циркулирующих наивных Т-клеток просто не хватит для полной реставрации их пула в будущем. Конечно же, такой подход будет эффективен и для женского пола. Эти образцы крови будут не только средством продления жизни, но ещё и подстраховкой в случае аутоиммунных заболеваний или рака, они помогут восстановить иммунную систему после химиотерапии. Создание подобных банков с замороженными образцами крови стало бы ключевым событием в становлении абсолютно новых подходов к лечению заболеваний иммунной системы. Например, СПИД можно было бы вылечить введением в здоровые размороженные Т-клетки заразившегося СПИДом мутации по гену мембранного рецептора CCR5 (CD195), люди с такой мутацией обладают природной резистентностью к ВИЧ [8], и их пересадкой больному, предварительно прошедшему курс химиотерапии.
Итоги
Как бы молодо не выглядел человек, параметры его иммунной системы будут объективно отражать возраст. Такие параметры как количество наивных Т-клеток и разнообразие TCR практически линейно снижаются по мере старения. Если вы являетесь счастливым обладателем повышенного разнообразия TCR, можете надеяться на несколько бонусных лет жизни. В будущем человечество ожидают новые дерзкие подходы к увеличению продолжительности жизни с использованием собственных наивных Т-лимфоцитов, собранных и замороженных много лет назад.